tFUS的机制概述
核心机制:低强度经颅聚焦超声(tFUS)通过机械-生物物理效应调制神经活动,包括:
机械应变梯度改变神经元膜蛋白构象,引发去极化;
热力学膜波促进动作电位,激活机械敏感通道;
微管超声共振影响突触可塑性;
空化形成瞬态膜孔促进离子流动;
热调制激活温敏离子通道(兴奋/抑制取决于参数)。
效应规律:高强度/长时程→兴奋,低强度/短时程→抑制(一致协议待研究)。
优势:非侵入、深达8cm(远超TMS的2-3cm)、毫米级空间精度(1-5mm)、不受组织导电性影响、可靶向皮层/皮层下(如SCC、丘脑)。
HUIYING
tFUS系统分系统概述
tFUS系统分tFUS子系统(生成/传递声波)和神经导航子系统(精准靶向+实时监控),结合图1描述:
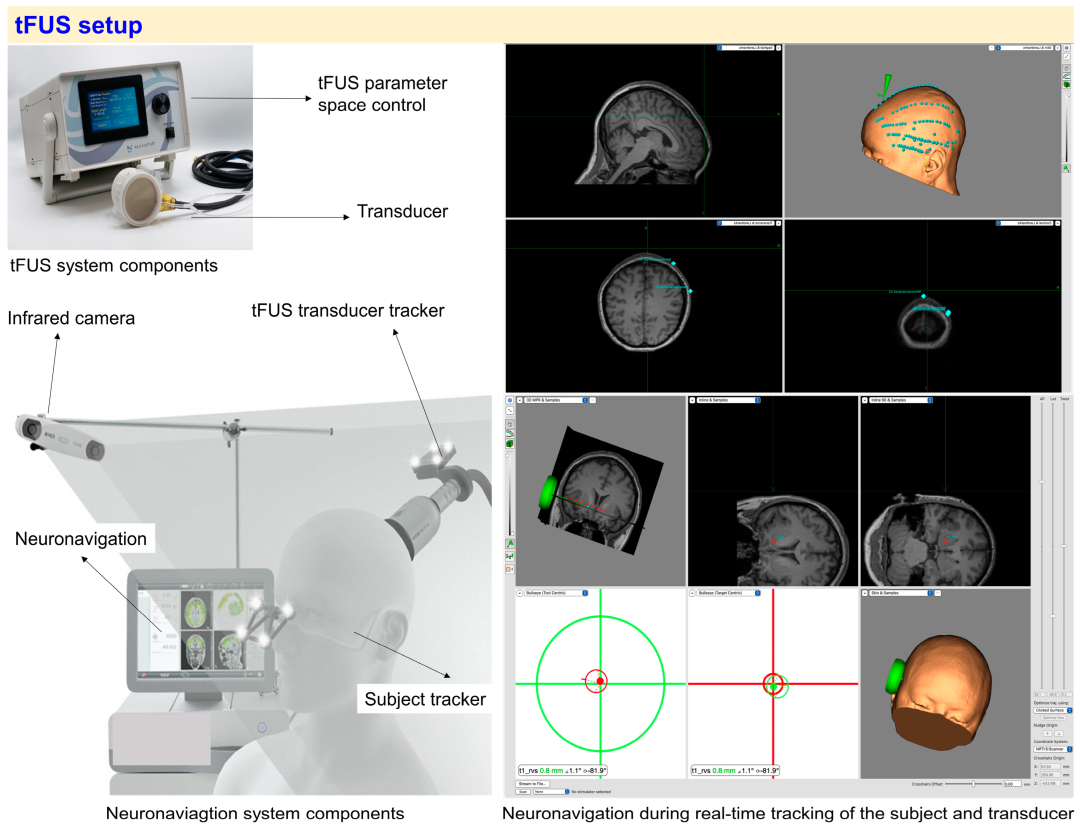
图1:tFUS设置的关键组件概述图
图1分三部分展示tFUS系统的核心组成:左上面板:tFUS子系统(控制单元+换能器),改编自BrainBox制造商,展示参数控制与超声波生成/传递的核心硬件;左下面板:神经导航子系统(红外相机),改编自NEUROLITH-TPS制造商,展示用于实时跟踪受试者头部与换能器位置的红外追踪系统;右面板:实时神经导航示例(Brainsight软件V2.5.3),包括:① 绿点标记的头皮配准点(用于脑MRI与头部位置的实时配准);② 目标脑区与换能器位置的3D可视化(确保刺激精准性)。作用分析:直观呈现tFUS系统的“硬件-导航”双核心架构,帮助理解“如何生成超声”与“如何精准靶向”的关键逻辑,是tFUS技术落地的物理基础。
tFUS子系统
控制单元:调整/控制刺激参数(强度、频率、时长),可手动或电脑脚本/GUI操作。
换能器:将电信号转为机械超声能,形状(平/凹/相控阵)决定焦深与空间精度(图1左上面板,改编自BrainBox)。
神经导航子系统
红外相机:实时跟踪受试者头部与换能器位置,补偿移动错位(图1左下面板,改编自NEUROLITH-TPS)。
换能器追踪器:传输换能器位置至导航系统,确保波束对准靶点。
受试者追踪器:红外标记跟踪头部,实时补偿移动。
导航系统:整合数据,3D可视化大脑,引导换能器至靶点(图1右面板,Brainsight软件示例:绿点为头皮配准点,目标/换能器位置确保准确)。
神经导航子系统工作流程:
神经导航子系统是tFUS实现精准靶向的核心“引擎”,其通过红外相机(硬件“眼睛”,图1左下面板,捕捉头部与换能器位置)、换能器追踪器(报告换能器位置与角度)、受试者追踪器(监测头部移动轨迹)、导航系统(软件“大脑”,图1右面板Brainsight软件,整合数据、3D可视化、实时计算调整)四组件协同,以“定位-跟踪-调整-引导”流程解决“超声波束打不准”问题:准备阶段通过头皮配准点(绿点)将实时头部与术前MRI配准,标记目标与换能器初始位置;刺激阶段红外相机持续拍摄,头部移动时追踪器报告位移,导航系统实时计算换能器调整量(方向/距离)并通过机械臂/视觉提示补偿,确保焦点(误差<1-5mm)始终落在目标脑区(如SCC);结束阶段记录数据验证精准性。其本质是“tFUS的GPS”,让tFUS从“盲打”变“精准打击”,是靶向深脑结构(如SCC、丘脑)的关键保障,解决非侵入性刺激中“找不到、打不准”痛点,确保疗效与安全。
HUIYING
tFUS系统参数概述
结合图2(几何与参数示意图),分换能器参数与刺激参数:
图2:tFUS换能器几何结构与参数示意图
图2以几何示意图量化tFUS的“空间-时间”特征。含换能器参数(孔径直径D、曲率半径R,决定焦斑与焦深)和刺激参数(基频FF、声振时长SD、声压P(t)、脉冲时长PD、刺激间隔ISI、脉冲重复频率PRF,衍生参数占空比DC=PD×PRF表示超声active时间占比)。
换能器参数
孔径直径(D):换能器active表面直径,大则焦斑窄、精度高,但技术难度大。
曲率半径(R):换能器表面曲率半径,小则波束更聚焦,但过小会降低焦深/体积。
刺激参数(5核心)
基频(FF, kHz):超声频率,低频(深穿透、低分辨率)vs高频(高分辨率、低穿透),常用200-650kHz。
声振时长(SD, S):超声脉冲串时长,长则能量多但易过热/空化。
脉冲重复频率(PRF, Hz):脉冲串内脉冲速率。
占空比(DC, %):超声active时间占比(=脉冲时长PD×PRF)。
强度(I, W/cm²):单位面积声能,与压力平方成正比,分3类测量:
自由场强度:开放环境(如水箱)的换能器原始输出;
衰减后强度(Derated):调整软组织衰减(I_derated=I_free×10^(-α×d),α=0.3dB/cm/MHz);
原位强度:目标深度实际强度(考虑骨/软组织吸收)。
安全参数
空间峰时间平均(Ispta)、空间峰脉冲平均(Isppa):估能量分布;
机械指数(MI):负峰压/√FF,估空化风险(MI≤1.9,FDA标准);
热指数(TI):估过热风险(ITRUSst共识:温升<2°C或热剂量<0.25CEM43)。
HUIYING
tFUS靶向脑区的声学模拟概述
声学模拟是通过计算建模预测超声在颅内的传播与聚焦,确保焦点精准落在目标脑区并符合安全规范(图3)。
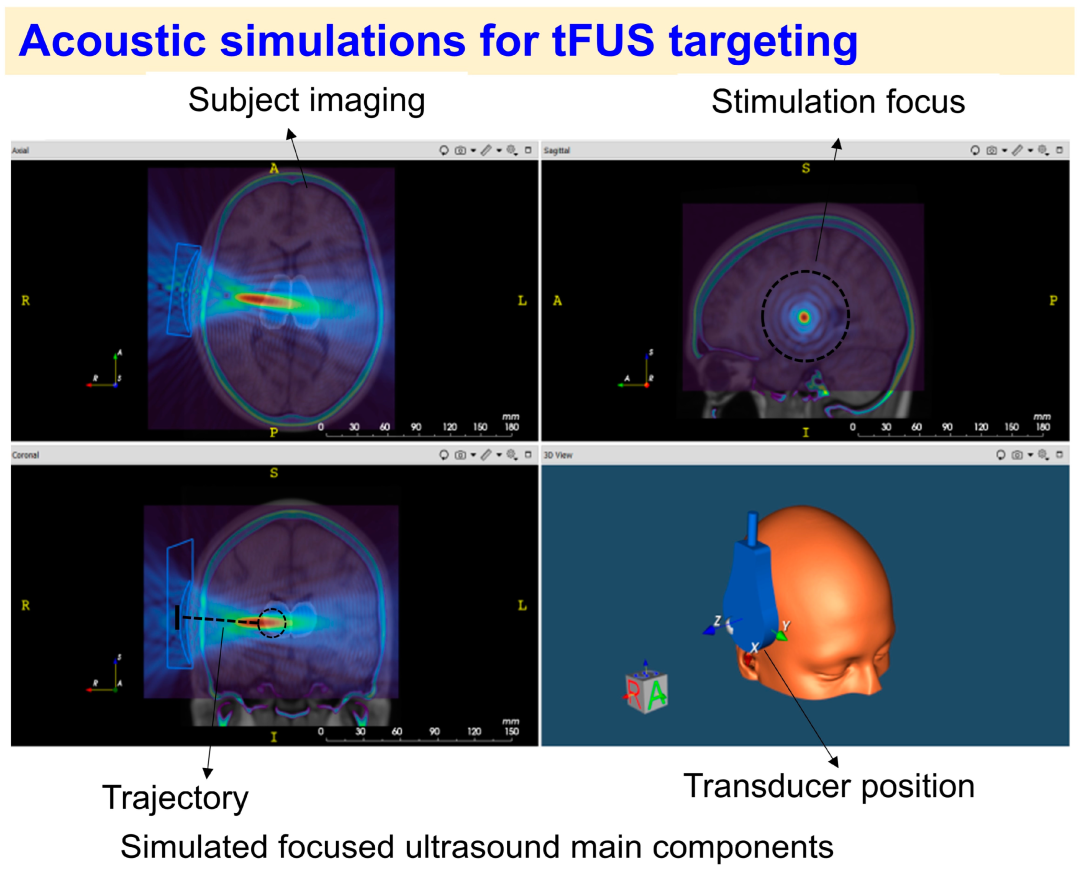
图3:tFUS靶向脑区的声学模拟示意图
图3展示tFUS靶向的声学模拟流程。基于个体神经影像(T1/T2 MRI、CT/ZTE/PETRA),用软件(k-Wave、BabelBrain、k-plan)生成3D头骨-脑模型,模拟换能器位置、声学焦点、声振协议,评估声学效应(波束聚焦)与热效应(温度上升),结合MNI或native坐标确定靶点深度与轨迹,确保符合安全规(FDA/ITRUSST)。作用:解决颅骨衰减难题,通过模拟优化参数,是tFUS从“理论”到“临床”的关键步骤。
目的与必要性
颅骨对超声的反射(~30%)、折射(~20%)、吸收(~50%)导致能量衰减与焦点偏移(如SCC靶点实际强度可能仅为自由场的10-20%),模拟可:① 优化换能器参数(D、R、FF)以补偿衰减;② 预测焦点位置(误差<2mm)与热效应(TI<2°C);③ 避免损伤(如避开颅骨骨缝、气房)。
步骤与工具
影像数据获取:高分辨率T1-MRI(1mm³,脑结构分割)、CT(0.5mm³,颅骨厚度/密度)、ZTE/PETRA(0.1mm³,骨小梁细节);
3D模型构建:用SimNIBS软件分割头皮、颅骨、脑脊液(CSF)、脑实质,生成四面体网格模型(节点数>10⁶);
声学模拟:
k-Wave(时域模拟):输入换能器参数(D=5cm, R=8cm, FF=650kHz)、组织声速(头皮1450m/s、颅骨4000m/s、脑1550m/s),计算声压场与温度场;
BabelBrain(频域分析):评估焦斑大小(1-3mm)与旁瓣抑制比(>20dB);
k-plan(临床优化):结合MNI坐标(如SCC: 0, 10, -20)与个体影像,自动推荐换能器位置/角度(图3,改编自BrainBox k-plan软件);
优化目标:焦点落在目标脑区(如SCC),TI<2°C,MI<1.9,焦斑覆盖靶点(体积<10mm³)。
HUIYING
tFUS研究的假刺激策略与效果评估方法概述
图4:tFUS研究的假刺激策略与效果评估方法示意图
图4分两部分规范研究设计。左面板为假刺激(Sham)策略与盲法流程:受试者随机分“active(tFUS ON)”或“sham(tFUS OFF)”,用凝胶垫/空气垫最小化感知差异,确保盲法;右面板为效果评估方法:离线评估(pre/post tFUS的静息态fMRI(rs-fMRI)、高密度EEG(hd-EEG)),在线评估(同步tFUS与rs-fMRI/hd-EEG捕捉即时神经变化)。作用:解决“排除安慰剂效应”与“量化神经变化”的核心问题,保障临床研究可靠性。
假刺激策略(图4左面板)
为排除安慰剂效应(如听觉/触觉/热感混淆),需使假刺激(sham)与真实刺激(active)在感知上不可区分,常用方法:
换能器定位不发射:换能器置于靶点位置但不输出超声,保留触觉(压力)与听觉(骨传导声),需结合白噪声掩蔽(如耳机播放40dB噪声);
换能器倒置/散焦:换能器凹面背对头部(波束发散)或调整曲率(焦斑扩大至>1cm),减少能量聚焦;
高阻抗阻断:在换能器与头皮间放置硅橡胶垫(声阻抗2.5MRayl,接近颅骨)或空气层(声阻抗0.0004MRayl),阻断>90%超声能量;
刺激非靶区:如刺激脑室(无神经元)或运动皮层(与症状无关),需确保神经效应可区分。
关键挑战:听觉(~30%受试者可感知脉冲声)、触觉(~20%报告头皮压力)是主要混淆因素,需通过双盲设计+主观报告验证盲法有效性(如Cheung 2023中仅43.75% sham组误认active)。
效果评估方法(图4右面板)
离线评估(pre/post刺激):
神经影像:静息态fMRI(rs-fMRI)分析脑网络(如DMN、情绪网络)功能连接(FC)变化(如SCC抑制后DMN FC降低);任务态fMRI(如情绪图片任务)评估BOLD信号变化;
电生理:高密度EEG(hd-EEG,64-256导)分析时频特征(如theta/beta功率、相位同步),源定位(sLORETA)确定激活脑区;
在线评估(同步刺激):
tFUS-fMRI:用MR-ARFI(磁化率加权超声辐射力成像)实时监测焦点位移(精度0.1mm),同步记录BOLD信号(如视觉皮层刺激后V1激活);
tFUS-EEG:记录刺激中诱发电位(如SEP)与频谱变化(如感觉皮层刺激后beta功率增加)。
HUIYING
临床研究1:抑郁症
抑郁症(6研究:3双盲对照+1 vs等待list+2病例)
方法:
本研究为随机、双盲、假对照临床试验(NCT04405791),通过图5A展示的流程招募MDD患者(最终23例完成:verum组11人、sham组12人),随机分配至真实tFUS组(verum)或假刺激组(sham);干预为2周内6次tFUS刺激左背外侧前额叶皮层(DLPFC,MNI坐标-42,44,30),使用NS-US100设备(250kHz频率、3W/cm²空间峰值脉冲平均强度,图5B为设备与头架 setup),每次20分钟,声学焦点特性如图5C(FWHM直径8.5mm、长51mm,覆盖靶区);评估包括基线、治疗结束、随访(2周)的MADRS(主要结局)、QIDS-SR、SSI、K-POMS等量表(图1A),及静息态功能磁共振(rsfMRI)分析膝下前扣带回(sgACC)亚区与全脑的功能连接(FC),入组流程见图5D。
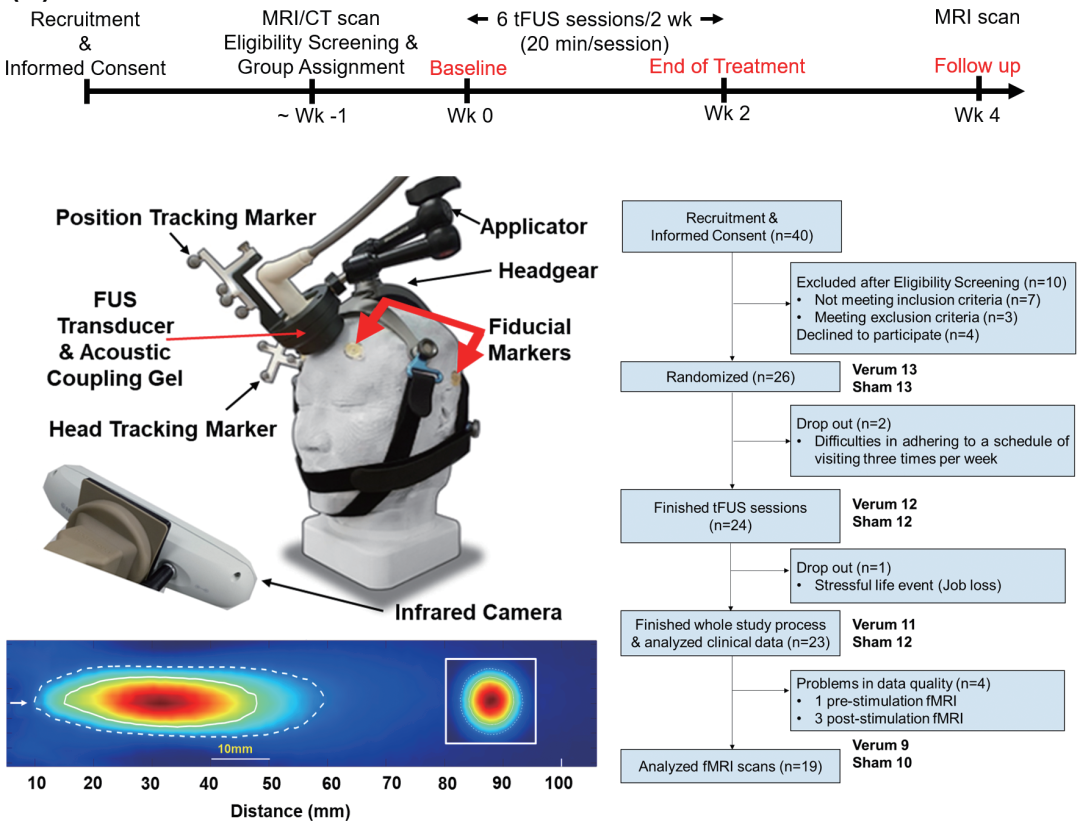
图5 研究设计与实验流程
图5以“研究设计与实验流程”为核心,通过A-D四个子图系统呈现研究的方法学框架:A为实验流程序列,明确“基线评估→2周内6次tFUS(20分钟/次)→治疗结束评估→2周随访评估(含二次MRI)”的时间线;B为tFUS设备 setup 示意图,展示NS-US100设备、头架、 fiducial markers(用于空间配准)及红外实时跟踪头动的设计;C为声学焦点映射,以白虚线标注-6 dB压力(FWHM,50%强度)的椭球轮廓,明确焦点直径8.5mm、长51mm,覆盖横向(20×20mm²)与纵向(60×100mm²)平面,白实线为-3 dB压力(75%强度),体现tFUS的高空间选择性;D为入组流程图,从40名初始招募者中排除14人(含不符合MDD标准、MRI禁忌、MADRS评分低、精神疾病等),26人随机分verum/sham组(各13人),最终23人完成研究(11 verum、12 sham),4人rsfMRI数据因质量问题排除,19人用于FC分析。本图完整呈现研究的可重复性与方法学严谨性,为结果解读提供基础。
结果:
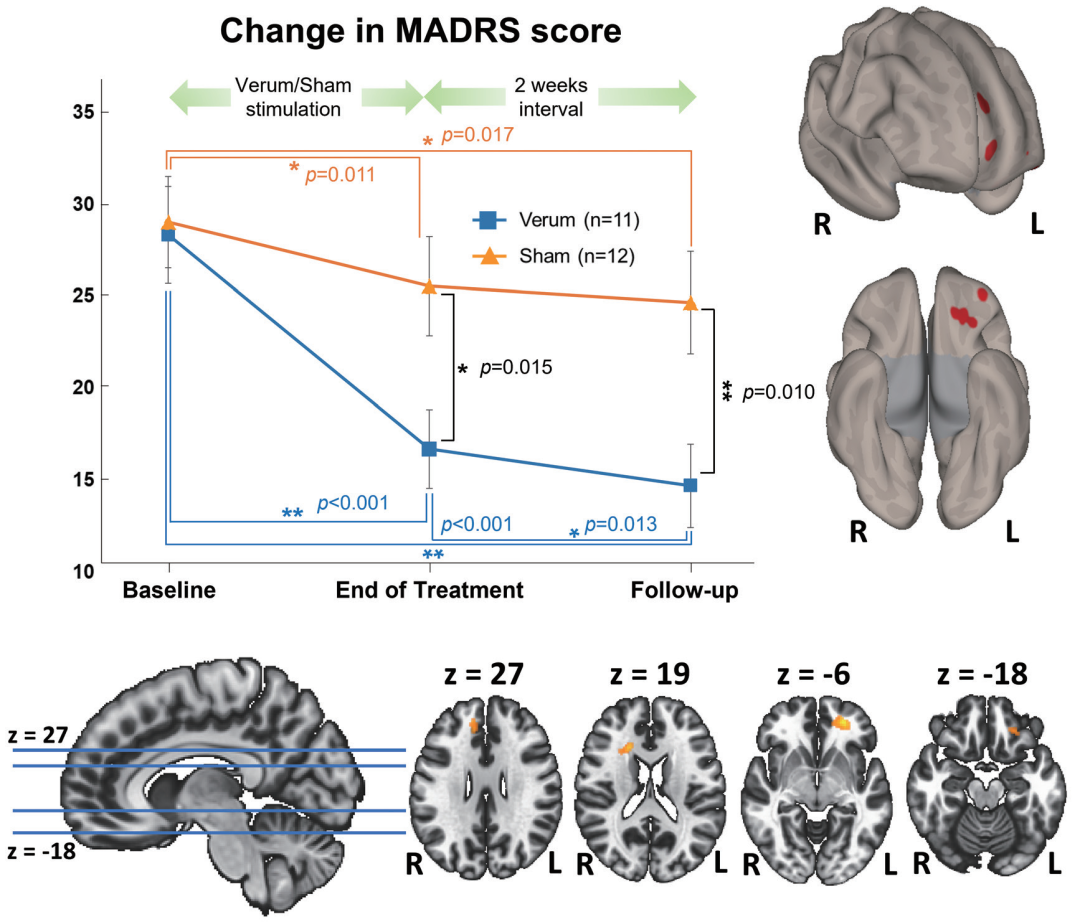
图6 MADRS评分变化与功能连接分析结果
图6以“MADRS评分变化与功能连接分析结果”为主题,通过A-C三个子图直观验证研究假设:A为MADRS评分变化曲线,蓝线(verum组)从基线28.5±8.4降至随访14.8±7.2,橙线(sham组)从29.2±8.3降至24.8±9.3,误差棒示标准误,组×时间交互作用显著(p=0.003),直接证明tFUS的临床有效性;B为3D渲染 flatten 脑表面图(前视图+底视图),C为轴位解剖图,共同展示verum组治疗后右侧sgACCRS(膝下前扣带回 superior 亚区)与左内侧前额叶(-24,46,-6)、左中额回(-12,40,30)、右尾状核(18,24,18)、左眶额叶(-16,36,-22)的功能连接(FC)显著增强(红伪彩),而sham组无此变化。图6量化临床疗效并可视化神经机制,支撑“tFUS通过调控sgACC亚区网络改善抑郁”的结论。
结果显示tFUS安全耐受(无头痛、脑损伤等不良反应);临床疗效上,verum组MADRS从基线28.5±8.4降至随访14.8±7.2,sham组从29.2±8.3降至24.8±9.3,组×时间交互作用显著(p=0.003)(图6A直观展示verum组下降更明显);verum组反应率(MADRS降≥50%)54.5%显著高于sham组8.3%(p=0.027)。rsfMRI分析(图6B/C)发现,verum组治疗后右侧sgACC superior(sgACCRS)与左内侧前额叶、左中额回、右尾状核、左眶额叶的FC显著增加(组间差异p<0.05),sham组无此变化,提示tFUS通过调控sgACC亚区网络改善抑郁症状(图6B/C展示verum组FC增强的脑区)。
HUIYING
临床研究2:自闭症谱系障碍
自闭症谱系障碍(1双盲随机对照)
方法:
本研究为双盲、随机、假对照试验,纳入32名12-17岁ASD青少年(27男5女),按1:1随机分配至真实TPS组(16人)或假刺激组(16人)。真实组接受6次TPS干预(2周内隔日进行),采用NEUROLITH TPS系统(图7展示BodyTrack导航系统:含追踪眼镜、3D相机、手具),基于个体MRI T1加权像(图8显示rTPJ刺激区域)靶向右侧颞顶联合区(rTPJ,社会认知关键节点),参数为能量0.2-0.25 mJ/mm²、频率2.5-4.0 Hz、每次800脉冲(30分钟/次);假组操作同真实组,但手具用空气垫代替硅油(模拟声音/触感,无有效刺激)。结局指标包括主要结局(父母评定的儿童自闭症评定量表CARS总分)、次要结局(AQ、ASAS、SRS、TMT、VFT、Stroop测试、数字跨度、临床总体印象CGI),统计分析用混合模型重复测量(协变量年龄、性别),Bonferroni校正事后检验,计算Cohen's d效应量。

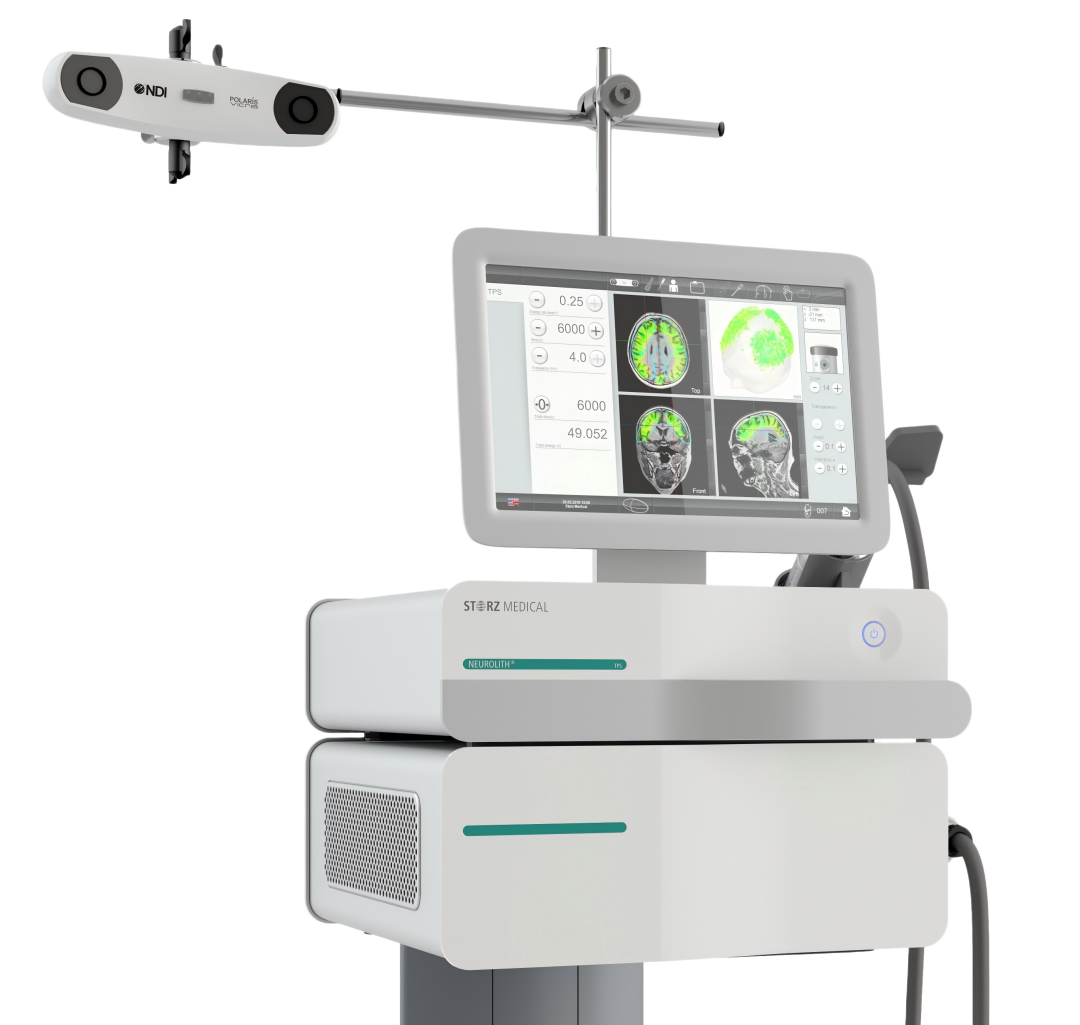
图7 NEUROLITH TPS系统BodyTrack实时导航组件及3D红外相机精准定位示意图
图7展示NEUROLITH经颅脉冲刺激(TPS)系统的核心导航组件——BodyTrack实时导航系统,由3D红外相机(顶部组件,采用NDI 3D红外技术)、带检测镜片/标记的追踪眼镜(患者佩戴)、带检测镜片/标记的TPS手具(医生操作)组成,通过BodyTrack软件实现实时3D可视化:3D红外相机高精度跟踪手具与头部位置,结合患者个性化MRI数据(如右侧颞顶联合区rTPJ),经3步手动校准(红/蓝/绿步骤)匹配脑区,以彩色高亮显示治疗区域与脉冲分布,确保超声脉冲精准作用于目标脑区,实现“从概念到操作”的精准刺激流程。
结果:结果显示两组基线 socio-demographic 无显著差异(表1)。核心症状改善:真实组CARS总分从基线30.81降至2周后23.44、1个月23.44、3个月23.56(总减少24%,组×时间交互作用P=0.02,图8rTPJ刺激区域关联症状缓解);CGI总分从10.81降至3个月5.81(减少53.7%),效应量2周/1个月达大效应(CARS d=0.83-0.95,CGI improvement d=4.12-4.37),3个月降至小效应(d=2.31,表2-6)。次要结局:真实组Stroop Test 2、TMT2/3(执行功能)、VFT(30秒言语流畅性)、数字跨度( forward/backward工作记忆)均有显著时间效应(P<0.05,表2)。安全性与盲法:真实组1/3(5人)出现短暂头痛(3-5/10分,无用药缓解),假组无不良反应;盲法有效(假组43.75%猜错分组,图1流程验证)。结论:6次TPS靶向rTPJ可有效、耐受改善青少年ASD核心症状,效应可持续至3个月(表3-4 CARS分项改善)。
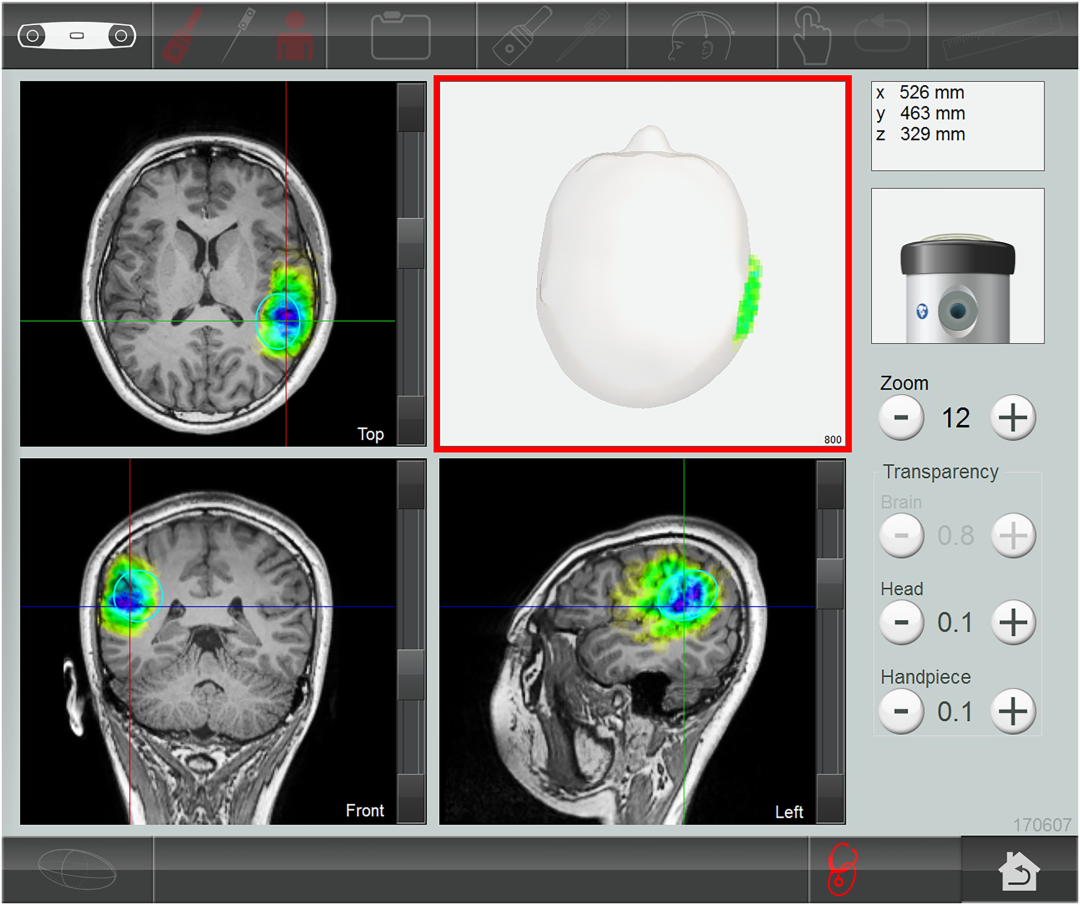
图8 真实参与者MRI T1加权像标记右侧颞顶联合区(rTPJ)TPS刺激区域
图8展示真实参与者接受TPS干预后的MRI T1加权像,核心是通过BodyTrack软件(NEUROLITH系统的“心脏”)标记右侧颞顶联合区(rTPJ,社会认知关键节点)的刺激区域。图中基于个性化MRI数据,以彩色高亮(如绿色)显示rTPJ的位置(x/y/z坐标)与深度;该标记通过3D红外相机(BodyTrack系统组件)实时跟踪TPS手具位置,结合患者头部追踪眼镜的红外标记,确保刺激点与MRI靶点精准匹配。
总结
tFUS是安全、精准、深达的新型神经调控技术,核心优势是靶向皮层下结构(如SCC、丘脑),机制涉及机械/热/空化效应。系统分tFUS(控制单元+换能器)与导航(红外跟踪+3D可视化),参数需标准化(ITRUSST建议)。临床研究初步显示抑郁、精神分裂、焦虑、物质使用障碍、自闭症有症状改善,但样本小、sham需优化(如听觉/触觉混淆)。未来需大样本、神经生物指标(fMRI/EEG)、参数优化,以推动临床转化。tFUS有望填补非侵入深脑调控的空白,但当前成本高、操作复杂,需进一步普及。
HUIYING
回映产品
产品1:便携式经颅聚焦超声(tFUS)设备(ODM定制开发)
本经颅聚焦超声(tFUS)系统是一款基于回映电子自主独有技术路线的无创脑调控平台,专为神经调控科研与临床干预设计。其核心优势在于通过回映3D视觉导航系统(融合红外感应与3D成像技术)实现亚毫米级靶点定位,结合回映精准调控软件平台,将患者个性化MRI数据(轴向/冠状/矢状面三维重建)与实时手具位置跟踪联动,确保超声脉冲精准作用于目标脑区(如社会认知相关颞顶联合区)。系统采用高精度脉冲驱动电路,通过可编程参数控制模块实现能量密度(低能量范围可调)、频率(灵活编程)、脉冲持续时间(短脉冲设计)的精准设置,支持可编程的疗程方案。其自适应头戴结构与手具动态定位设计,可适配不同头型与脑区深度(最大穿透8cm),确保刺激稳定性。安全层面,集成实时温度监控与功率闭环管理,当检测到组织温升接近阈值时自动调节输出,全程无创、无副作用。该平台集成了精准导航、可编程超声调控、个性化机械适配与主动安全保护,为神经退行性疾病(如阿尔茨海默病)、神经发育障碍(如自闭症)等提供靶向、可控的超声干预工具。(产品系统如下图NEUROLITH Transcranial Pulse Stimulation (TPS)设备类似)
回映便携式经颅聚焦超声设备示意图
产品2:携式经颅光生物调节(tPBM)设备(可ODM定制开发)
本便携式经颅光生物调节(tPBM)设备是一款基于精确光剂量控制的科研与健康工具。其核心技术优势在于通过高精度PWM信号调控恒流源驱动电路,确保了每个LED光输出功率的高度稳定性和可重复性,为实现可靠的研究结果和一致的体验提供了基础。设备的光照参数具备高度可编程性。用户可通过配套应用灵活设置光的强度、脉冲频率(如40Hz)及占空比,以适应不同的探索方向。其可调节的头戴结构与LED模块的个性化定位设计,使设备能精准适配不同使用者的头部尺寸和解剖特征,确保光斑稳定覆盖目标脑区。在安全性与可靠性方面,设备集成了实时温度监控与动态功率管理闭环。当系统检测到LED温度接近阈值时,会自动调节驱动电流,确保设备始终在安全范围内工作。其设计兼顾了佩戴的舒适性与使用的便捷性,适用于多种应用场景。总而言之,该设备是一个集成了精密恒流驱动、可编程PWM调控、个性化机械适配与主动热管理的技术平台,旨在为相关领域提供一种剂量可控、靶向精准且安全可靠的光学干预工具。

回映携式经颅光生物调节设备示意图
产品3:便携无创脑脊接口设备(可ODM定制开发)
回映这款非侵入性脑脊接口整机设备是一个高度集成的闭环神经调控系统,其核心工作流程始于一个配备32个电极的便携式脑电帽,用于无创采集用户大脑感觉运动皮层的神经信号。这些信号被实时传输至内置的信号处理与计算单元,该单元运行着先进的机器学习算法(线性判别分析,LDA),能够从特定的脑电节律(μ波和β波)中持续解码出下肢的运动意图,并将其量化为一个实时的“运动概率”。一旦该概率值超过预设阈值,计算单元会即刻向经皮脊髓电刺激器发出触发指令。刺激器则通过精准贴附于使用者背部T10脊髓节段和腹部的电极,输送出与运动意图同步的、特定参数(如30Hz,10-15mA)的电刺激,以激活脊髓神经网络,辅助运动完成。整个系统通过统一的硬件同步机制,确保了从“意念识别”到“脊髓刺激”整个环路的时间精度,最终形成一个由“大脑意图驱动、脊髓刺激辅助”的一体化康复设备,旨在通过这种精准的闭环干预促进脊髓损伤患者的神经功能重塑与运动功能恢复。

便携无创脑脊接口设备示意图
产品4:多模态闭环经耳迷走神经电刺激taVNS系统
本产品是一款创新的多模态闭环经皮耳迷走神经刺激(taVNS)系统,通过集成可穿戴生物传感器和智能反馈算法,实现基于实时生理信号的精准神经调控。系统核心采用非侵入性taVNS技术,刺激耳甲腔(如CO10穴)和耳甲艇(如CO15穴)的迷走神经分支,通过呼吸、心电(ECG)、脑电(EEG)和肌电(EMG)等多模态生物信号实时调整刺激参数,从而针对不同疾病机制提供个性化干预。
呼吸+taVNS:通过呼吸门控技术,将taVNS同步于呼气相位(如0.1 Hz慢呼吸),以增强迷走神经张力,优化心血管调节和焦虑缓解。
心电+taVNS:基于实时心电信号(如HRV分析),系统自动调整taVNS的强度和时序,以维持自主神经平衡。
EEG+taVNS:集成耳部EEG传感器,监测α波等脑电活动,当检测到注意力波动时触发taVNS,通过激活蓝斑-去甲肾上腺素系统提升认知功能。
EMG+taVNS:在运动康复中,EMG信号(如上肢肌肉活动)实时触发taVNS bursts,强化神经可塑性。
所有传感器和taVNS模块采用轻量化、无线设计,确保用户在日常环境中舒适使用。系统支持长时间监测和刺激,并通过云平台进行数据追踪与参数优化。基于闭环多模态设计,本产品不仅适用于睡眠障碍、焦虑、认知障碍、偏头痛和癫痫等传统适应症,还可针对中风后运动康复、注意力提升及心血管疾病管理提供辅助治疗。通过生物反馈的实时自适应,治疗效率显著高于开环系统。
 回映多模态闭环经耳迷走神经电刺激taVNS设备示意图
回映多模态闭环经耳迷走神经电刺激taVNS设备示意图
 回映自研多模态闭环经耳迷走神经电刺激耳甲电极
回映自研多模态闭环经耳迷走神经电刺激耳甲电极
产品5:单通道肌电/心电/皮电采集设备
单通道肌电采集设备创新性地采用type-C转脑电电极以简单轻便的方式实现了单通道肌电、心电、皮电采集,且基于结构与硬件的特殊设计,支持高原环境下进行采集。另外产品总体结构采用魔术贴设计,方便于全身佩戴。
适用领域:单通道生理参数采集
 单通道肌电/心电/皮电采集设备
单通道肌电/心电/皮电采集设备
产品6:便携式TI时域干涉经颅电刺激仪
便携式TI时域干涉经颅电刺激仪通过紧密接触于头皮的电极传导两路不同频率的高频脉冲电流(如:2000Hz和2010Hz),高频电流流经大脑表层和深部区域,并在脑深部干涉产生低频包络(如:10Hz),由于大脑神经元对高频(>1000Hz)电刺激不响应,所以位于大脑表层的高频电流并没有对大脑产生刺激效应位于脑深部的低频包络刺激大脑,实现无创地刺激大脑深部而不影响大脑皮层,即无创脑深部电刺激。
回映便携式时域干涉电刺激设备支持传统的tTIS时域干涉电刺激模式(基于正弦波),PWM-TI时域干涉电刺激模式(基于50%占空比方波),burst-TI时域干涉电刺激模式,细分为tTI-iTBS,tTI-cTBS两种模式(基于iTBS,cTBS).
适用范围:
能够应用于对老年痴呆、癫痫、帕金森、抑郁症等多种神经系统疾病治疗和神经科学研究的多个领域。
回映便携式TI时域干涉经颅电刺激仪设备示意图
产品7:48通道8脑区同步高精度经颅电刺激设备
回映电子科技院线级多脑区高精度经颅电刺激设备(MXN-48)是一款可8脑区/8人同步干预的高精度经颅电刺激实验平台。其已突破了Soterix对该技术的垄断(Soterix产品Soterix MXN-33 高精度经颅电刺激系统其之前是市面上唯一款可对不同脑区进行同步精确干预的设备)回映高精度经颅电刺激产品M×N-48其具有48个独立输出通道,每个通道的波形,强度等参数都可以独立设置,可以实现对8个不同脑区的同步干预,不同脑区的相位同步性<0.1°,大大增强了tES的神经调控效果。回映高精度经颅电刺激设备提供了两种不同的操作模式以供研究者选择——基础模式和自由模式。基础模式使用更加方便,设定简单;自由模式则允许导入自定义电流波形,功能更加强大。
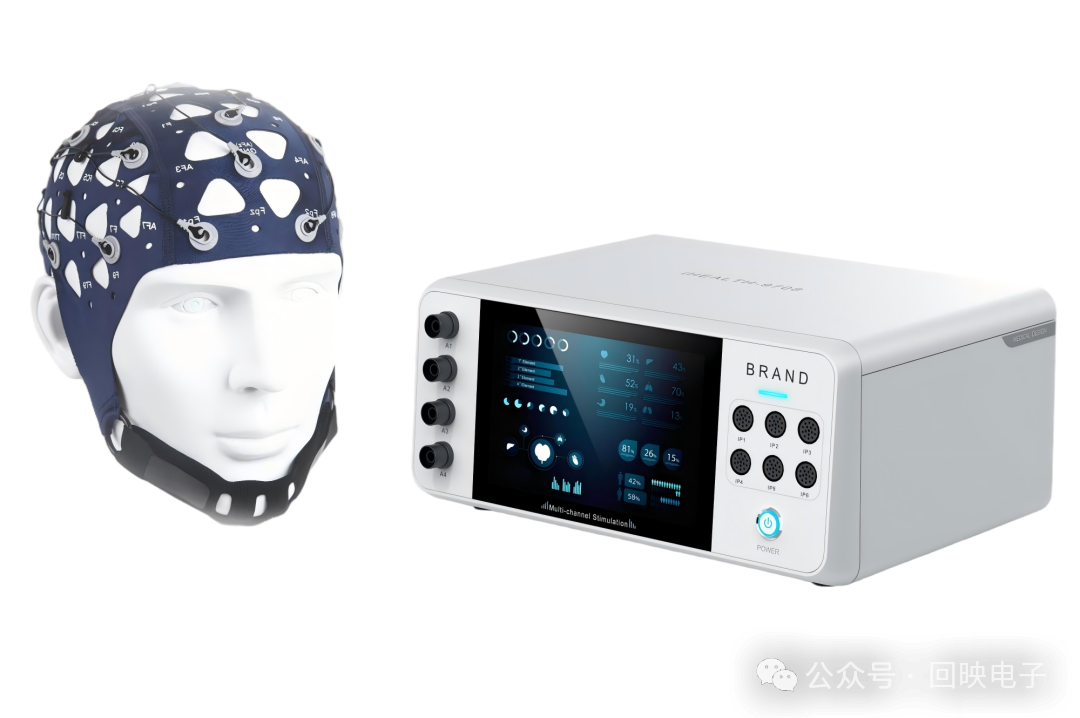 回映自研 48通道8脑区同步高精度经颅电刺激设备
回映自研 48通道8脑区同步高精度经颅电刺激设备
适用范围:康复医学:运动功能障碍、语言障碍、认知障碍、吞咽障碍、意识障碍、上肢肌张力障碍、卒中后抑郁、卒中后疼痛等精神病学:抑郁症、焦虑症、强迫症、物质成瘾、创伤后应激障碍﹑精神分裂症等儿童康复:脑瘫、运动功能障碍、注意缺陷多动障碍、孤独症、阅读障碍、语言发育迟缓等神经病学:睡眠障碍、耳鸣、慢性疼痛、帕金森病、纤维肌痛、慢性疼痛(脊髓损伤下肢)、阿尔茨海默病、单侧忽略﹑偏头痛、神经性疼痛等脑科学研究:记忆、学习、言语等
推荐阅读: